format_list_bulleted Contenido
- Introducción: La revolución silenciosa de la medicina de precisión
- El concepto del pegamento molecular: Más allá de la inhibición tradicional
- El avance científico: Química de alto rendimiento y screening celular
- Caso práctico: ENL y la leucemia aguda
- Metodología sistemática: Del descubrimiento fortuito al diseño racional
- Implicaciones terapéuticas: Proteínas "intratables" ahora alcanzables
- Análisis en video
- El futuro de los pegamentos moleculares
- Conclusión: Un nuevo paradigma en el descubrimiento de fármacos
El pegamento molecular: La revolución silenciosa que está redefiniendo el descubrimiento de fármacos
En el vasto universo de la investigación biomédica, ocasionalmente surge un avance que no solo resuelve un problema específico, sino que redefine completamente cómo abordamos una clase entera de enfermedades. El desarrollo de los pegamentos moleculares representa precisamente uno de esos momentos transformadores. Estas pequeñas moléculas, capaces de inducir interacciones entre proteínas que normalmente no se unirían, están abriendo nuevas fronteras en el tratamiento de enfermedades antes consideradas "intratables".
science Un nuevo paradigma terapéutico
"Las células constantemente monitorean y reciclan sus proteínas a través de un sistema de eliminación de residuos estrictamente regulado. Las proteínas que ya no son necesarias son etiquetadas y descompuestas por maquinaria celular especializada. Los avances recientes en el descubrimiento de fármacos buscan explotar este sistema redirigiéndolo hacia objetivos relevantes para la enfermedad".
Como observador de la intersección entre la química medicinal y la biología celular durante más de una década, me resulta fascinante cómo los pegamentos moleculares están transformando nuestro enfoque del diseño de fármacos. En lugar de intentar bloquear activamente una proteína objetivo —el enfoque tradicional de la farmacología—, estos compuestos engañan a la propia célula para que elimine la proteína problemática. Es un cambio de paradigma sutil pero profundo: de la inhibición a la eliminación.
biotech El concepto del pegamento molecular: Más allá de la inhibición tradicional
Para comprender verdaderamente la importancia de este avance, debemos primero considerar las limitaciones del enfoque tradicional en el descubrimiento de fármacos. Durante décadas, la estrategia dominante ha sido desarrollar moléculas que se unen a un sitio activo en una proteína objetivo y bloquean su función. Este enfoque ha funcionado remarkably bien para muchas proteínas, especialmente enzimas con sitios activos bien definidos.
Sin embargo, se estima que aproximadamente el 85% de las proteínas humanas carecen de sitios activos adecuados para la unión de fármacos convencionales. Estas proteínas, a menudo llamadas "intratables", incluyen muchos factores de transcripción, reguladores de la cromatina y proteínas de andamiaje que son cruciales en enfermedades como el cáncer y los trastornos neurodegenerativos.
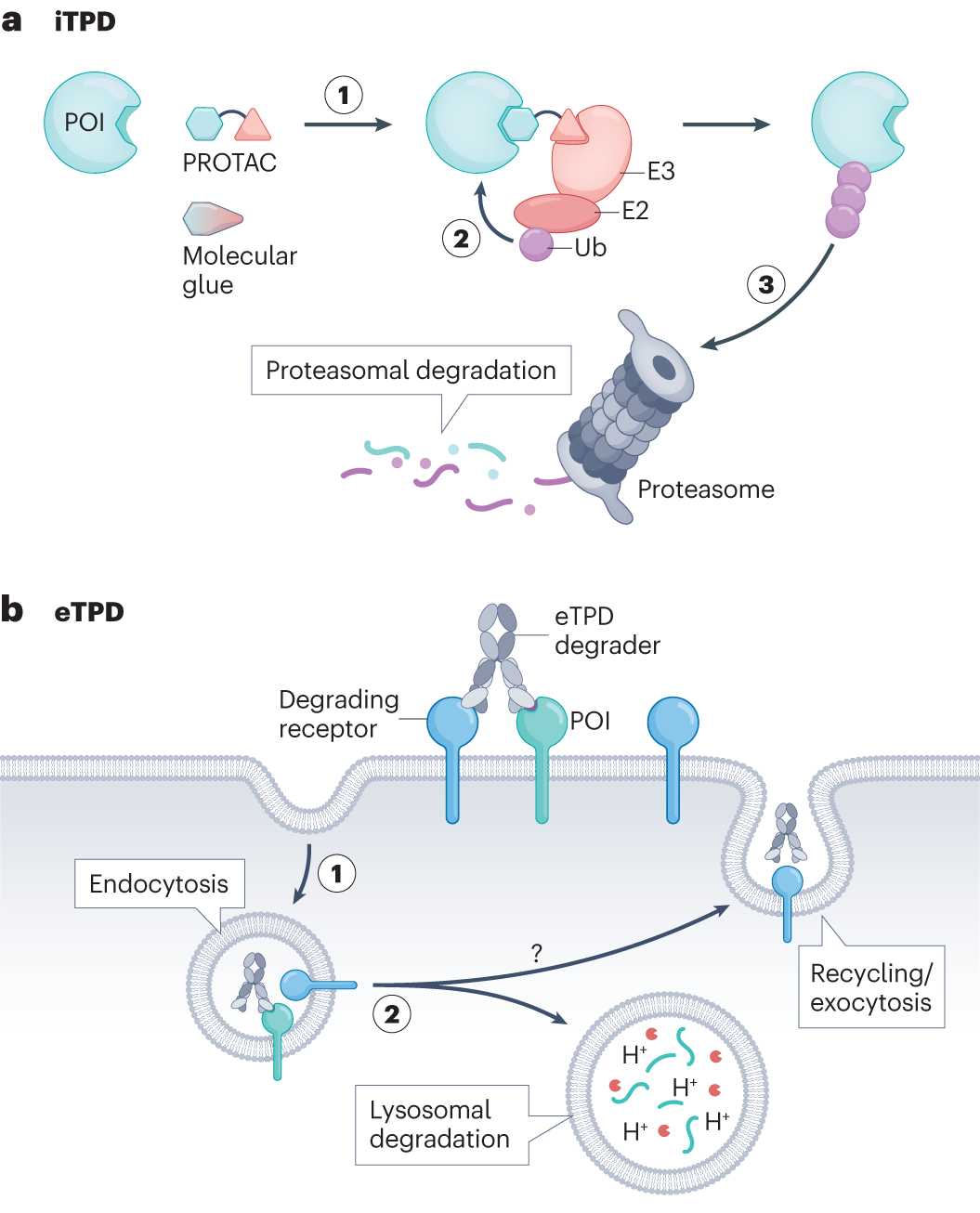
Los pegamentos moleculares ofrecen una solución elegante a este desafío. En lugar de bloquear una proteína, actúan como intermediarios moleculares que "pegan" una proteína objetivo a una enzima celular específica llamada ligasa de ubiquitina E3. Una vez que las dos proteínas están en estrecha proximidad, la ligasa de ubiquitina etiqueta la proteína objetivo con moléculas de ubiquitina, marcándola efectivamente para destrucción por el proteasoma, el "incinerador de basura" celular.
precision_manufacturing La elegancia de la cooperatividad
"Este modo de acción cooperativo es lo que hace que los pegamentos moleculares sean poderosos y selectivos. El compuesto solo se vuelve activo en el contexto molecular correcto, lo que ayuda a limitar los efectos no deseados". Esta selectividad contextual es una de las características más atractivas de los pegamentos moleculares, ya que sugiere la posibilidad de terapias con menos efectos secundarios.
El concepto no es completamente nuevo. La talidomida, tristemente famosa por sus efectos teratogénicos, fue más tarde redescubierta como un tratamiento eficaz para el mieloma múltiple precisamente porque funciona como un pegamento molecular, dirigiendo la degradación de proteínas específicas. Sin embargo, hasta hace poco, el descubrimiento de nuevos pegamentos moleculares ha sido en gran medida fortuito, limitando su aplicación terapéutica más amplia.
auto_awesome El avance científico: Química de alto rendimiento y screening celular
El avance reciente, desarrollado por los equipos de Georg Winter (Director Científico del Instituto de Investigación Biomédica de Inteligencia Artificial AITHYRA e Investigador Principal Adjunto en el CeMM Research Center for Molecular Medicine en Viena, Austria) y Michael Erb (Profesor Asociado en el Scripps Research Institute en La Jolla, California, EE. UU.), aborda directamente esta limitación.
El nuevo método comienza con una pequeña molécula que ya se une a una proteína objetivo. A partir de este compuesto inicial, los investigadores generaron miles de variantes químicas adjuntando sistemáticamente diferentes bloques de construcción moleculares. Cada variante remodela sutilmente la superficie de la proteína, potencialmente permitiendo nuevas interacciones proteína-proteína.
science Química de alto rendimiento
El proceso utiliza técnicas de química combinatoria para crear bibliotecas de miles de compuestos relacionados. Cada compuesto representa una modificación sutil de la molécula original, explorando sistemáticamente el espacio químico alrededor del sitio de unión.
Este enfoque permite a los investigadores explorar la diversidad química a una escala que antes era impráctica, identificando rápidamente las variantes que tienen el efecto biológico deseado.
biotech Screening celular directo
Crucialmente, estos compuestos se analizaron directamente en células vivas, sin purificación previa, utilizando un ensayo sensible que informa si la proteína objetivo está siendo degradada.
Este enfoque basado en células permite una identificación rápida de compuestos activos de un vasto espacio químico, mientras que simultáneamente proporciona información sobre la actividad biológica en un entorno fisiológico relevante.
analytics Identificación rápida de activos
La combinación de química de alto rendimiento y screening celular permite a los investigadores identificar rápidamente compuestos activos de miles de variantes potenciales.
Este proceso acelera drásticamente el ciclo de descubrimiento, permitiendo la identificación de pegamentos moleculares prometedores en semanas en lugar de meses o años.
"Nuestro enfoque combina química de alto rendimiento con pruebas funcionales en células", explica Miquel Muñoz i Ordoño, co-primer autor del estudio y estudiante de doctorado en el laboratorio de Georg Winter. "Esto nos permite explorar la diversidad química a una escala que antes era impráctica, mientras vemos inmediatamente qué compuestos tienen el efecto biológico deseado".

Este enfoque sistemático representa un cambio fundamental con respecto a los métodos anteriores, que dependían en gran medida del descubrimiento fortuito. Al combinar la síntesis química automatizada con el screening biológico directo, los investigadores han transformado el descubrimiento de pegamentos moleculares de un proceso serendipitoso a un flujo de trabajo sistemático y escalable.
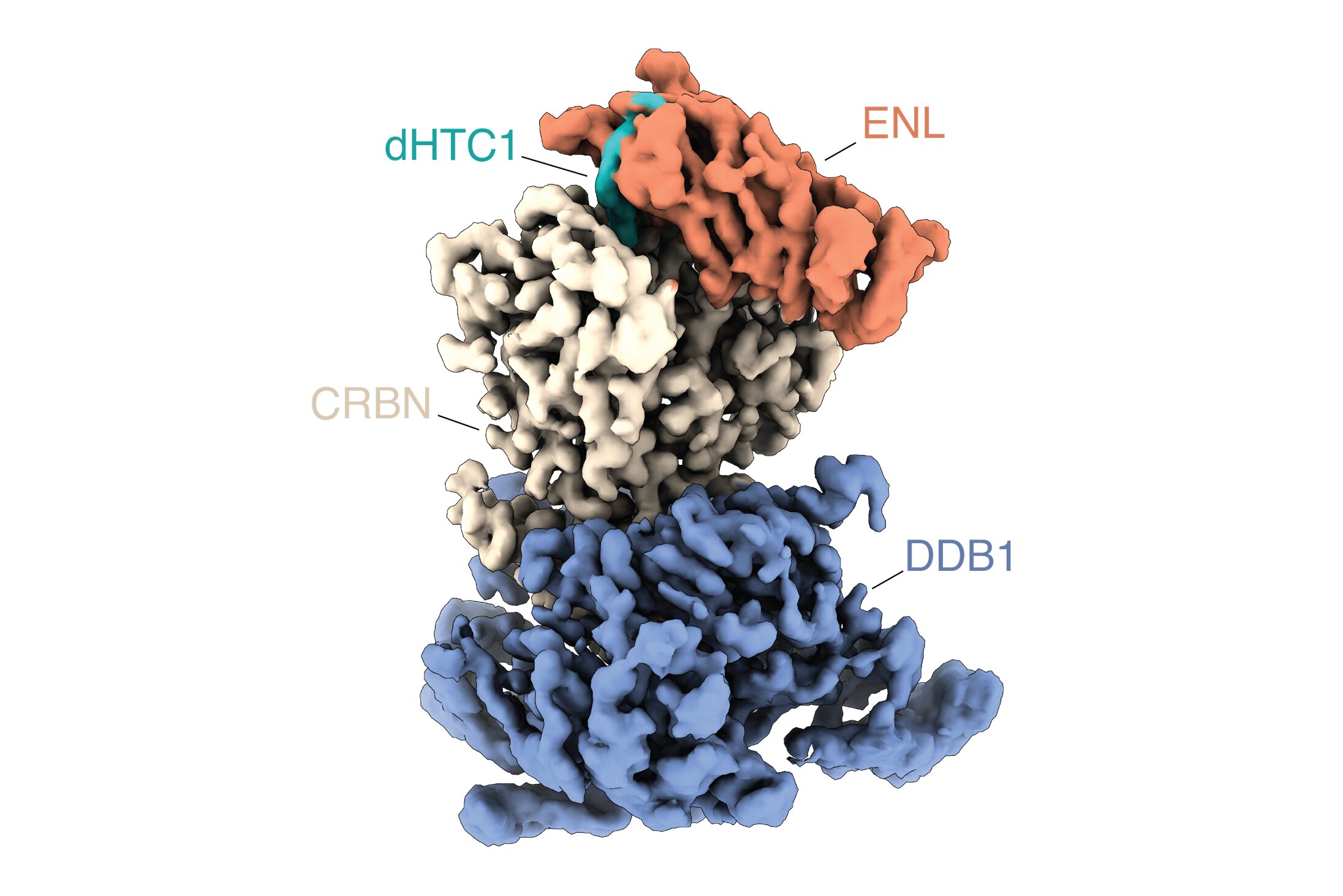
healing Caso práctico: ENL y la leucemia aguda
Como prueba de principio, los investigadores se centraron en ENL, una proteína que juega un papel central en ciertas formas de leucemia aguda. Las fusiones de genes que involucran a ENL se encuentran en aproximadamente el 10% de los pacientes con leucemia mieloide aguda (LMA) y están asociadas con un pronóstico particularmente pobre.
De varios miles de compuestos probados, el equipo identificó una molécula que degrada de manera eficiente y selectiva a ENL en células de leucemia. Análisis adicionales mostraron que el compunto afecta principalmente a ENL y a los programas génicos posteriores controlados por esta proteína, lo que lleva a una fuerte reducción del crecimiento de células de leucemia dependientes de ENL.
precision_manufacturing Mecanismo de acción cooperativo
También revelaron que el compuesto actúa a través de un mecanismo cooperativo característico de los pegamentos moleculares. En lugar de unirse fuertemente a todos los socios de interacción, primero se une a ENL y luego crea una nueva superficie de interacción que recluta una ligasa de ubiquitina celular, que marca a ENL para su degradación.
Este mecanismo de acción es particularmente elegante porque demuestra cómo los pegamentos moleculares pueden lograr una selectividad notable. El compuesto solo se vuelve activo en el contexto molecular correcto —cuando tanto ENL como la ligasa de ubiquitina están presentes— lo que ayuda a limitar los efectos no deseados en otras células donde estos componentes no están presentes en la misma configuración.
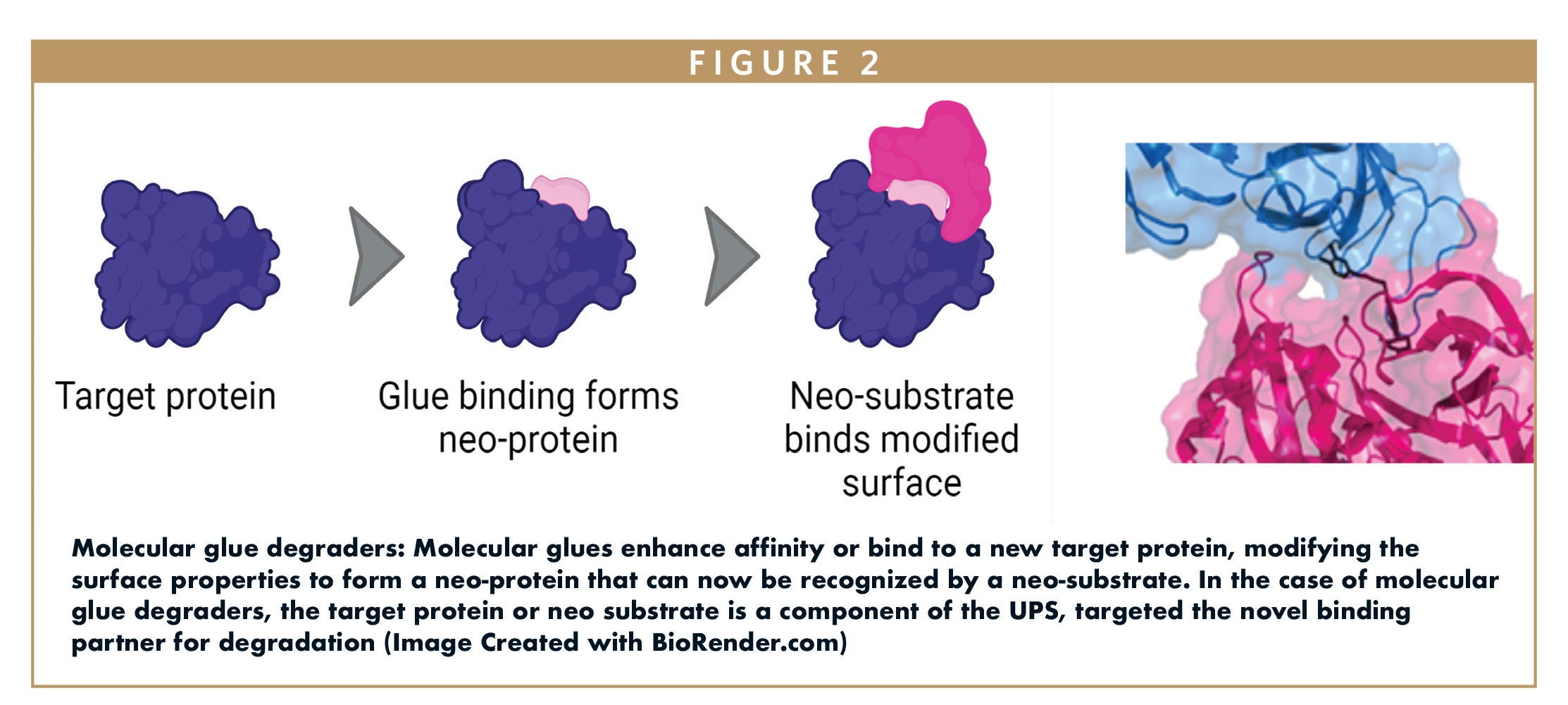
El éxito con ENL es particularmente significativo porque representa una prueba de concepto del método. Si bien ENL no es el único objetivo potencial, su degradación selectiva demuestra que el enfoque puede identificar compuestos activos contra objetivos clínicamente relevantes. Además, el hecho de que ENL sea una proteína de difícil abordaje con enfoques farmacológicos tradicionales resalta aún más el valor del enfoque de pegamento molecular.
schema Metodología sistemática: Del descubrimiento fortuito al diseño racional
Más allá del ejemplo específico de ENL, el estudio publicado en Nature Chemical Biology (DOI 10.1038/s41589-025-02137-2) demuestra una estrategia de descubrimiento ampliamente aplicable. Al combinar química de alto rendimiento con screening funcional en células, los investigadores muestran cómo la identificación de pegamentos moleculares puede transformarse de un proceso serendipitoso a un flujo de trabajo sistemático.
Este cambio metodológico es crucial para el avance del campo. El descubrimiento fortuito, aunque valioso, es inherentemente limitado en escala y previsibilidad. Al desarrollar un enfoque sistemático, los investigadores pueden aplicar la misma metodología a múltiples objetivos, acelerando drásticamente el ritmo del descubrimiento.
format_quote Georg Winter
"Nuestro objetivo es hacer que los fármacos inductores de proximidad sean descubribles de manera racional y escalable. A largo plazo, esto podría abrir oportunidades terapéuticas completamente nuevas para proteínas que antes se consideraban intratables".
- Director Científico del Instituto AITHYRA
Este enfoque sistemático también permite la optimización iterativa. Una vez que se identifica un compuesto activo, los investigadores pueden realizar rondas adicionales de síntesis y screening para mejorar sus propiedades —potencia, selectividad, farmacocinética— creando un ciclo de diseño racional y prueba experimental.
trending_up El potencial de la IA en el descubrimiento
Dado que el método implica la generación y evaluación de miles de compuestos, hay un potencial significativo para la integración de la inteligencia artificial. Los algoritmos de aprendizaje automático podrían predecir qué variantes químicas son más propensas a producir la superficie de interacción deseada, priorizando la síntesis y el screening hacia los compuestos más prometedores.
Además, el enfoque podría extenderse a otras modalidades de fármacos inductores de proximidad, como los PROTACs (proteolysis-targeting chimeras), que son moléculas bifuncionales que unen simultáneamente una proteína objetivo y una ligasa de ubiquitina. Los principios aprendidos del descubrimiento de pegamentos moleculares podrían informar el diseño racional de estas y otras modalidades emergentes.
medical_services Implicaciones terapéuticas: Proteínas "intratables" ahora alcanzables
Las implicaciones terapéuticas de este avance son profundas y de amplio alcance. Al proporcionar un método sistemático para descubrir pegamentos moleculares, los investigadores ahora pueden abordar proteínas que antes se consideraban "intratables" con fármacos convencionales.
coronavirus Enfermedades infecciosas
Los pegamentos moleculares podrían dirigirse a proteínas virales esenciales para la replicación, ofreciendo nuevas estrategias para combatir virus que han desarrollado resistencia a los antivirales existentes.
La capacidad de degradar proteínas virales en lugar de simplemente inhibirlas podría reducir la probabilidad de resistencia viral.
psychology Trastornos neurodegenerativos
Proteínas mal plegadas como la tau en la enfermedad de Alzheimer o la alfa-sinucleína en la enfermedad de Parkinson podrían ser objetivos para pegamentos moleculares, promoviendo su eliminación antes de que formen agregados tóxicos.
Este enfoque podría abordar la causa subyacente de estas enfermedades en lugar de solo tratar los síntomas.
favorite Enfermedades autoinmunes
Los pegamentos moleculares podrían modular la actividad de las células inmunitarias al degradar proteínas reguladoras clave, ofreciendo nuevas estrategias para tratar enfermedades autoinmunes como la artritis reumatoide o la esclerosis múltiple.
La selectividad contextual de los pegamentos moleculares podría permitir una modulación precisa de la respuesta inmunitaria sin suprimirla por completo.
En el campo del cáncer, las implicaciones son particularmente emocionantes. Muchos cánceres son impulsados por proteínas de fusión o proteínas sobreexpresadas que son difíciles de dirigir con inhibidores convencionales. Los pegamentos moleculares podrían degradar estas proteínas oncogénicas, deteniendo el crecimiento del tumor en su origen.
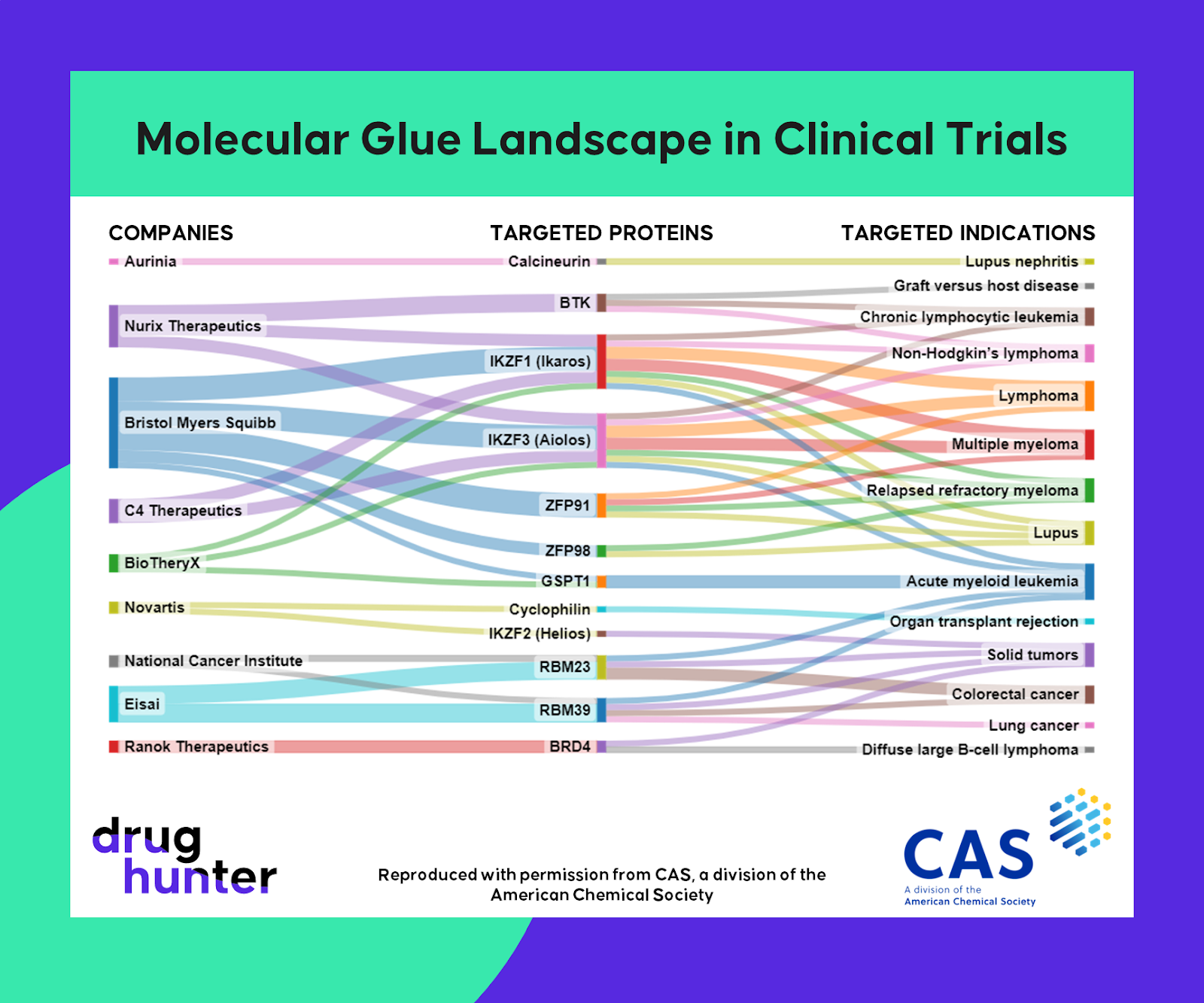
Además, los pegamentos moleculares podrían usarse en combinación con otras terapias. Por ejemplo, podrían usarse para degradar proteínas de resistencia que surgen en respuesta a terapias dirigidas, resensibilizando los tumores a los tratamientos existentes.
medication
Es importante tener en cuenta que, aunque el potencial es enorme, todavía quedan desafíos significativos. No todas las proteínas son susceptibles a la degradación mediada por pegamentos moleculares, y algunos compuestos pueden tener efectos no deseados. Además, la entrega de estos fármacos a los tejidos adecuados y la superación de las barreras biológicas siguen siendo desafíos importantes.
Sin embargo, con este nuevo enfoque sistemático, los investigadores están mejor equipados que nunca para abordar estos desafíos y traducir el potencial terapéutico de los pegamentos moleculares en realidades clínicas.
play_circle Análisis en video
Para comprender mejor el mecanismo de acción de los pegamentos moleculares y su potencial terapéutico, te invitamos a ver este video explicativo que ilustra cómo estas moléculas innovadoras están revolucionando el campo del descubrimiento de fármacos:
school Perspectiva de expertos
El video presenta análisis de expertos del IRB Barcelona que explican el concepto de "pegamento molecular" y cómo estos compuestos están abriendo nuevas posibilidades en el tratamiento de enfermedades. También discuten los desafíos futuros y las direcciones de investigación en este campo emergente.
rocket_launch El futuro de los pegamentos moleculares
Mirando hacia el futuro, el campo de los pegamentos moleculares está preparado para una expansión rápida. El método sistemático desarrollado por los equipos de Winter y Erb proporciona un modelo que otros laboratorios pueden adoptar y adaptar, acelerando el descubrimiento en todo el campo.
Una área de desarrollo particularmente emocionante es la integración con otras tecnologías emergentes. La inteligencia artificial podría usarse para predecir qué superficies de proteínas son más propensas a formar interacciones inducidas por pegamentos moleculares, guiando el diseño de compuestos. La microscopía crioelectrónica podría revelar las estructuras de los complejos de proteínas inducidos por pegamentos moleculares a resolución atómica, informando el diseño racional de compuestos mejorados.
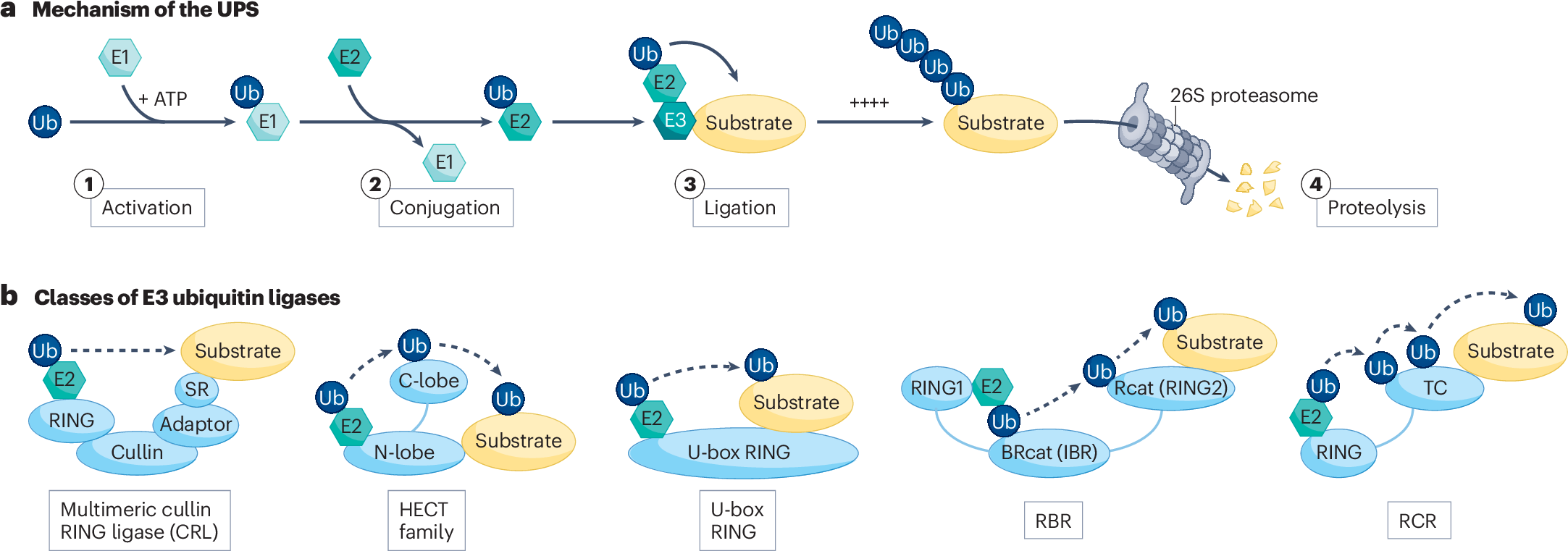
Además, podríamos ver la expansión a nuevas clases de pegamentos moleculares. Mientras que la mayoría de los pegamentos moleculares conocidos dirigen proteínas a ligasas de ubiquitina específicas como CRBN, DCAF15 o VHL, los investigadores podrían desarrollar compuestos que dirijan proteínas a otras enzimas celulares, abriendo aún más posibilidades terapéuticas.
diversity_3 Personalización médica
Los pegamentos moleculares también podrían jugar un papel importante en la medicina personalizada. Dado que diferentes pacientes pueden tener diferentes variantes de proteínas objetivo, podrían desarrollarse pegamentos moleculares específicos para cada variante, permitiendo tratamientos verdaderamente personalizados.
Esta capacidad de adaptación podría ser particularmente valiosa en enfermedades como el cáncer, donde la heterogeneidad tumoral a menudo limita la eficacia de los tratamientos convencionales.
Sin embargo, también habrá desafíos que abordar. La regulación de los pegamentos moleculares podría ser compleja, ya que representan una nueva clase de agentes terapéuticos con mecanismos de acción únicos. Los ensayos clínicos deberán diseñarse cuidadosamente para evaluar tanto la eficacia como la seguridad de estos compuestos.
Además, habrá que abordar preguntas fundamentales sobre la biología de la degradación de proteínas. ¿Qué sucede cuando se degradan proteínas que son esenciales para la función celular normal? ¿Cómo pueden las células adaptarse a la pérdida crónica de ciertas proteínas? Comprender estos aspectos biológicos será crucial para desarrollar pegamentos moleculares seguros y efectivos.
psychology Conclusión: Un nuevo paradigma en el descubrimiento de fármacos
El desarrollo de un método sistemático para el descubrimiento de pegamentos moleculares representa un hito significativo en el campo del descubrimiento de fármacos. Al transformar lo que antes era un proceso fortuito en un flujo de trabajo racional y escalable, los equipos de Winter y Erb han abierto nuevas posibilidades para tratar enfermedades que antes se consideraban intratables.
Este avance no es solo un logro técnico; es un cambio fundamental en cómo pensamos sobre la modulación de proteínas. En lugar de ver las proteínas como objetivos que deben ser bloqueados o activados, los pegamentos moleculares nos enseñan a verlas como entidades dinámicas que pueden ser redirigidas o eliminadas por completo.
lightbulb La sabiduría de la naturaleza
En muchos sentidos, los pegamentos moleculares representan un retorno a la sabiduría de la naturaleza. Las células ya han desarrollado sistemas sofisticados para regular sus proteínas a través de la degradación. Los pegamentos moleculares simplemente aprenden a hablar el lenguaje de la célula, engañando a su sistema de eliminación de residuos para que haga lo que queremos que haga.
Esta perspectiva —trabajar con los sistemas biológicos naturales en lugar de contra ellos— podría ser la clave para desarrollar terapias más efectivas y menos tóxicas en el futuro.
A medida que avanzamos hacia un futuro de medicina cada vez más personalizada y precisa, los pegamentos moleculares sin duda jugarán un papel importante. Ofrecen una nueva herramienta en nuestro arsenal terapéutico, una que nos permite abordar enfermedades de maneras que antes eran imposibles.
El viaje desde el descubrimiento fortuito de la talidomida hasta el descubrimiento sistemático de pegamentos moleculares ha sido largo y tortuoso, pero el destino está claro. Estamos al umbral de una nueva era en el descubrimiento de fármacos, una era en la que las proteínas "intratables" ya no lo son, y en la que el poder del sistema de degradación de proteínas de la célula puede ser aprovechado para tratar algunas de las enfermedades más desafiantes que enfrenta la humanidad.
En el final, los pegamentos moleculares nos recuerdan que la innovación más poderosa a menudo viene de entender y trabajar con los sistemas naturales en lugar de intentar dominarlos. Al aprender el lenguaje de la célula y hablarlo a través de la química, estamos abriendo nuevas fronteras en la medicina y acercándonos a un futuro en el que más enfermedades que nunca antes pueden ser tratadas eficazmente.
"Los pegamentos moleculares representan más que una nueva clase de fármacos; representan un nuevo paradigma en cómo pensamos sobre la intervención terapéutica. En lugar de ver las proteínas como objetivos estáticos que deben ser bloqueados o activados, nos enseñan a verlas como entidades dinámicas que pueden ser redirigidas o eliminadas por completo. Este cambio de perspectiva —de la inhibición a la eliminación, del bloqueo a la redirección— podría ser la clave para desbloquear el potencial terapéutico de una de las áreas más inexploradas del proteoma humano. A medida que refinamos estos métodos y expandimos su aplicación, estamos presenciando el comienzo de una nueva era en el descubrimiento de fármacos, una era en la que las proteínas 'intratables' se convierten en las más tratables de todas, no a pesar de su complejidad, sino precisamente a través de ella."