Un avance pionero permite la creación precisa de estructuras biológicas directamente en tejidos profundos, abriendo un abanico de posibilidades en medicina regenerativa y entrega de fármacos.
Introducción: La Nueva Frontera de la Impresión 3D Biomédica: Directamente Dentro del Cuerpo
La impresión tridimensional (3D), una tecnología que ha revolucionado la fabricación industrial y el diseño, ha encontrado en la biomedicina un campo de aplicación con un potencial transformador inmenso. Durante años, los científicos han explorado la bioimpresión 3D para crear estructuras biológicas complejas ex vivo, es decir, fuera del cuerpo, en el entorno controlado de un laboratorio. Desde parches de piel personalizados y implantes dentales a medida hasta modelos de órganos para planificación quirúrgica e incluso prototipos de tejidos y órganos funcionales como hígados o riñones en miniatura, las posibilidades parecían casi ilimitadas. El objetivo final: fabricar órganos y tejidos a demanda para trasplantes, eliminando las listas de espera y los problemas de rechazo.
Sin embargo, la complejidad de replicar la arquitectura y función de los órganos humanos, así como la necesidad de vascularización y maduración de los tejidos impresos ex vivo, presentan desafíos significativos. ¿Pero qué pasaría si, en lugar de imprimir un tejido u órgano completo fuera y luego implantarlo, se pudiera imprimir el material biológico directamente donde se necesita, dentro del propio cuerpo? Esta idea, que hasta hace poco sonaba a ciencia ficción, está comenzando a materializarse gracias a avances pioneros en la interfaz entre la impresión 3D, la ciencia de materiales y las tecnologías de imagen médica.
Un equipo de científicos del Instituto Tecnológico de California (Caltech), liderado por expertos en ingeniería médica y biomateriales, ha logrado un hito que podría cambiar radicalmente el paradigma: han demostrado con éxito la capacidad de imprimir materiales 3D a demanda directamente dentro de los tejidos profundos de modelos animales (ratones y conejos). Este logro, detallado en una publicación reciente que ha captado la atención de la comunidad científica, se distingue de intentos anteriores por la técnica utilizada, que permite una penetración y precisión sin precedentes en el interior del organismo.
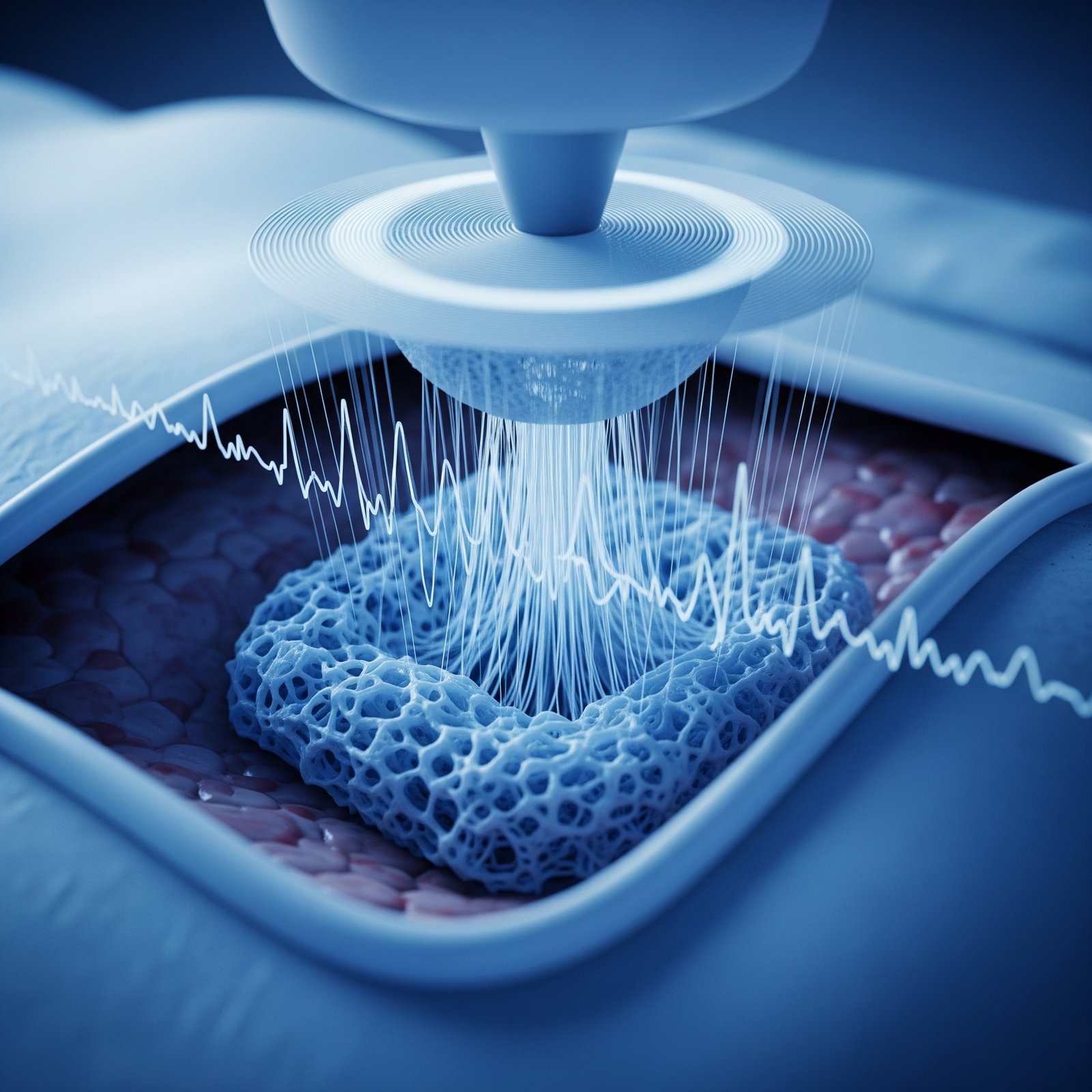
La clave de este avance reside en el uso de ultrasonidos focalizados para controlar la solidificación de una "biotinta" inyectable en un lugar específico y con una forma tridimensional predeterminada. A diferencia de métodos anteriores que se basaban en radiación infrarroja (limitada a aplicaciones superficiales, justo debajo de la piel), los ultrasonidos pueden penetrar profundamente en el cuerpo, alcanzando músculos, órganos internos e incluso el cerebro, abriendo un abanico de aplicaciones médicas que antes eran impensables para la impresión 3D in situ.
Este artículo explora en profundidad este emocionante avance y sus vastas implicaciones. Desglosaremos los antecedentes de la impresión 3D in vivo, detallaremos el ingenioso mecanismo detrás de la nueva técnica basada en ultrasonidos, exploraremos las aplicaciones potenciales que este hito podría desbloquear —desde la reparación de tejidos lesionados y la entrega precisa de fármacos contra el cáncer hasta la creación de componentes para dispositivos médicos implantables— y discutiremos los desafíos y los próximos pasos necesarios para traducir estos fascinantes resultados del laboratorio a la práctica clínica en humanos. Estamos, potencialmente, ante el amanecer de una nueva era en la medicina regenerativa y la intervención terapéutica, una era donde la fabricación aditiva ocurre, de manera controlada y precisa, dentro del propio paciente.
Antecedentes: Impresión 3D Ex Vivo y las Primeras Incursiones In Vivo con Limitaciones
La idea de imprimir materiales biológicos o biocompatibles directamente dentro del cuerpo no es completamente nueva, pero los métodos anteriores enfrentaban limitaciones significativas que restringían su aplicabilidad clínica. Para apreciar la magnitud del avance de Caltech, es crucial entender el contexto de la bioimpresión y las primeras aproximaciones a la impresión 3D in situ.
La Promesa de la Bioimpresión 3D Ex Vivo:
La bioimpresión 3D tradicional, realizada fuera del cuerpo, ha logrado avances notables en la creación de:
-
Tejidos Simples: Como piel, cartílago o hueso, utilizando biotintas que combinan células vivas con biomateriales que actúan como andamios. Estos se cultivan en biorreactores y luego se implantan.
-
Modelos de Órganos para Investigación: "Órganos en un chip" o mini-órganos (organoides) que replican aspectos de la estructura y función de órganos humanos, útiles para probar fármacos o estudiar enfermedades.
-
Implantes Personalizados: Prótesis, guías quirúrgicas o implantes médicos fabricados a medida a partir de imágenes médicas del paciente.
A pesar de estos progresos, la creación de órganos complejos y completamente funcionales ex vivo sigue siendo un objetivo a largo plazo debido a desafíos como la vascularización (crear redes de vasos sanguíneos), la maduración celular y la integración funcional con el cuerpo del receptor.
Primeros Intentos de Impresión 3D In Vivo:
La idea de evitar las complejidades de la bioimpresión ex vivo llevando la impresora directamente al paciente (impresión in situ o in vivo) ha sido explorada. Sin embargo, las primeras técnicas se basaban en fuentes de energía o métodos de polimerización que tenían limitaciones significativas, como se menciona en el artículo de Wired:
-
Uso de Radiación Infrarroja (o Luz UV/Visible): Algunas de las primeras aproximaciones utilizaban luz (infrarroja, ultravioleta o visible) para inducir la polimerización de una biotinta fotosensible inyectada. El problema fundamental de esta técnica es la limitada penetración de la luz en los tejidos biológicos. La luz es absorbida y dispersada rápidamente por los tejidos, lo que significa que este método solo podía utilizarse para imprimir materiales muy cerca de la superficie, como justo debajo de la piel o en cavidades accesibles.
-
Aplicaciones Superficiales: Debido a la baja penetración de la luz, las aplicaciones de la impresión 3D in vivo estaban restringidas a la reparación de defectos cutáneos, la creación de parches superficiales o la aplicación de biomateriales en áreas muy accesibles. La impresión en órganos internos o tejidos profundos era inviable.
-
Potencial Daño Tisular por Luz: El uso de luz de alta intensidad, especialmente UV, para la polimerización también podría plantear riesgos de daño a los tejidos circundantes.
Estos antecedentes ponen de manifiesto la necesidad de una técnica que pudiera superar la barrera de la penetración tisular para permitir la impresión 3D verdaderamente "dentro" del cuerpo, en ubicaciones profundas y de difícil acceso. Es aquí donde la nueva aproximación con ultrasonidos marca una diferencia fundamental.
El Salto Tecnológico: De la Limitada Radiación Infrarroja a la Penetración Profunda de los Ultrasonidos
El avance crucial del equipo de Caltech reside en su elección de la fuente de energía para controlar el proceso de impresión 3D in situ: los ultrasonidos. A diferencia de la luz (infrarroja, visible o UV), los ultrasonidos tienen la capacidad de penetrar profundamente en los tejidos biológicos con una absorción y dispersión significativamente menores. Esta propiedad es bien conocida y aprovechada en la medicina diagnóstica (ecografías) y terapéutica (litotricia, ultrasonido focalizado de alta intensidad o HIFU).
Ultrasonido vs. Luz: La Clave de la Penetración
Mientras que la luz es absorbida y dispersada rápidamente por los tejidos, limitando su alcance a unos pocos milímetros, los ultrasonidos pueden viajar a través de centímetros de tejido biológico con una atenuación mucho menor. Además, los haces de ultrasonido pueden ser focalizados con alta precisión en puntos específicos dentro del cuerpo, permitiendo depositar energía de manera controlada en regiones profundas sin dañar significativamente los tejidos superficiales.
Ultrasonido Focalizado como Activador Preciso:
El equipo de Caltech ha aprovechado esta capacidad de penetración y focalización del ultrasonido para desarrollar un sistema de impresión 3D in vivo que funciona de la siguiente manera general (los detalles del mecanismo se explorarán más adelante):
-
Biotinta Inyectable y Sensible al Calor: Se diseña una "biotinta" especial que contiene los precursores del material a imprimir y un componente clave que es sensible a un aumento localizado de temperatura.
-
Ultrasonido Focalizado para Calentar: Se utiliza un haz de ultrasonido focalizado, dirigido desde fuera del cuerpo, para calentar de manera precisa y controlada un pequeño volumen en el lugar exacto donde se desea que ocurra la impresión. El ultrasonido deposita energía acústica que se convierte en calor en el punto focal.
-
Solidificación Controlada: El aumento de temperatura inducido por el ultrasonido en el punto focal activa la biotinta (por ejemplo, rompiendo liposomas termosensibles que liberan agentes reticulantes, como se describe en el artículo), provocando que los polímeros se ensamblen y solidifiquen, formando el material 3D.
-
Escaneo y Creación de Estructuras: Moviendo el punto focal del haz de ultrasonido de manera controlada, se puede "escribir" o construir una estructura tridimensional capa por capa o punto por punto directamente dentro del tejido.
Esta aproximación representa un cambio de paradigma fundamental respecto a los métodos basados en luz. Libera la impresión 3D in vivo de las limitaciones de la superficie y abre la posibilidad de fabricar estructuras y administrar terapias en ubicaciones profundas como músculos, órganos internos o incluso el cerebro (aunque esto último presenta sus propios desafíos de penetración a través del cráneo).
La capacidad de llegar a estos puntos profundos es lo que dota a esta nueva técnica de un potencial de aplicaciones mucho más amplio y transformador en el campo de la biomedicina, acercando la visión de una medicina verdaderamente regenerativa y personalizada.
El Mecanismo de Impresión 3D In Situ Guiada por Ultrasonidos: Biotinta Inteligente y Calor Focalizado
El ingenio del avance de Caltech no solo reside en el uso de ultrasonidos como fuente de energía, sino también en el diseño de la biotinta y el mecanismo de activación preciso que permite la formación de estructuras 3D a demanda directamente dentro del cuerpo. El proceso implica una elegante combinación de ciencia de materiales, nanotecnología y física acústica.
Composición de la Biotinta Especializada:
La biotinta desarrollada por los investigadores es una formulación inyectable que contiene varios componentes clave, cada uno con una función específica. Aunque la composición exacta puede variar según el material final que se desee imprimir (ej. un hidrogel para regeneración de tejidos, un polímero cargado de fármaco, etc.), dos elementos son fundamentales según lo reportado:
-
Cadenas de Polímeros (Materia Prima): Estos son los bloques de construcción del material que se va a imprimir. Pueden ser polímeros biocompatibles y biodegradables que, una vez ensamblados, formarán la estructura 3D deseada. La elección del polímero dependerá de la aplicación (ej. rigidez, porosidad, capacidad de liberar fármacos).
-
Agentes Reticulantes Encapsulados: Estos son los "activadores" del proceso de solidificación. Los agentes reticulantes son moléculas capaces de formar enlaces químicos entre las cadenas de polímeros lineales, transformándolas en una red tridimensional cohesiva y estable (el biomaterial impreso). La clave aquí es que estos agentes reticulantes no están libres en la biotinta desde el principio. Si lo estuvieran, la biotinta se solidificaría inmediatamente después de la inyección, impidiendo su colocación precisa.
Liposomas Termosensibles: El "Interruptor" de Temperatura:
Para controlar cuándo y dónde se liberan los agentes reticulantes y comienza la solidificación, los científicos los encapsularon dentro de liposomas. Los liposomas son pequeñas vesículas esféricas formadas por una bicapa lipídica (similar a las membranas celulares). La innovación crucial es que estos liposomas fueron diseñados para ser termosensibles: permanecen intactos y mantienen los agentes reticulantes "secuestrados" a la temperatura corporal normal (alrededor de 37°C).
Sin embargo, estos liposomas están diseñados para romperse y liberar su contenido (los agentes reticulantes) cuando la temperatura se eleva a un umbral específico, que en este caso se estableció en aproximadamente 41.7°C. Esta temperatura es ligeramente superior a la temperatura corporal normal, pero lo suficientemente baja como para no causar daño tisular significativo si se aplica de forma localizada y breve. Salvo en casos de fiebre muy alta, el organismo no alcanza esta temperatura de forma natural, por lo que los liposomas actúan como un interruptor controlado por calor.
Ultrasonido Focalizado: La "Mano" que Activa el Interruptor:
Aquí es donde entra en juego el ultrasonido focalizado. Un transductor de ultrasonido, similar a los utilizados en ecografías pero capaz de enfocar la energía acústica con mayor precisión e intensidad, se dirige desde fuera del cuerpo hacia el punto exacto donde se desea realizar la impresión. La energía acústica del ultrasonido se convierte en calor en el punto focal. Mediante un control muy preciso de la intensidad y duración del haz de ultrasonido, los científicos pueden elevar la temperatura localmente en el punto focal hasta los 41.7°C (o el umbral de activación de los liposomas).
Cuando la temperatura en el punto focal alcanza este umbral:
- Los liposomas termosensibles en esa pequeña región se rompen.
- Los agentes reticulantes que contenían se liberan.
- Estos agentes comienzan a interactuar con las cadenas de polímeros presentes en la biotinta.
- Se forman enlaces químicos (reticulación) entre los polímeros.
- Los polímeros se ensamblan en una red tridimensional, solidificándose y formando el biomaterial en el lugar deseado.
Al escanear el punto focal del ultrasonido a través de un volumen tridimensional, siguiendo un patrón predeterminado (similar a como una impresora 3D tradicional mueve su cabezal de extrusión), los científicos pueden construir formas complejas capa por capa o punto por punto, directamente dentro del tejido.
Precisión Tridimensional Guiada por Sonido
La técnica combina una biotinta "inteligente" con liposomas termosensibles y el uso de ultrasonido focalizado como un "bisturí" de calor no invasivo. Esto permite la polimerización y solidificación del material solo en el punto exacto donde se aplica el calor ultrasónico, permitiendo la creación de estructuras 3D complejas en el interior del cuerpo con alta precisión espacial.
Este elegante mecanismo de control permite que la biotinta inyectada permanezca líquida y fluida hasta que se activa selectivamente en el lugar y momento precisos mediante el calor generado por el ultrasonido, ofreciendo un nivel de control espacial y temporal sin precedentes para la impresión 3D in vivo en tejidos profundos.
Tabla 1: Componentes Clave de la Biotinta y su Función en la Impresión 3D por Ultrasonido
| Componente | Descripción | Función Principal |
|---|---|---|
| Cadenas de Polímeros Biocompatibles | Macromoléculas lineales (ej. hidrogeles, polímeros sintéticos o naturales). | Materia prima o bloques de construcción del material 3D a imprimir. |
| Agentes Reticulantes | Moléculas capaces de formar enlaces químicos entre cadenas de polímeros. | Inducen la solidificación de los polímeros, formando una red tridimensional estable. |
| Liposomas Termosensibles | Pequeñas cápsulas lipídicas que encapsulan los agentes reticulantes. Diseñados para romperse a una temperatura específica (ej. ~41.7°C). | Actúan como "interruptor" térmico. Mantienen los agentes reticulantes inactivos hasta que se aplica calor, liberándolos solo en el punto focal del ultrasonido. |
| Medio Acuoso/Vehículo | Solución biocompatible que transporta los polímeros y los liposomas. | Permite la inyección de la biotinta y su distribución inicial en el tejido. |
| Fármacos u Otros Agentes (Opcional) | Pueden estar encapsulados dentro de los polímeros o liposomas. | Permite la entrega localizada y controlada de fármacos (ej. quimioterapia) en el sitio de impresión. |
Nota: La composición exacta de la biotinta puede variar significativamente según la aplicación específica.
Conclusión: Un Hito que Abre la Puerta a la Medicina del Futuro
El logro de los científicos de Caltech al demostrar la impresión 3D de materiales complejos directamente dentro de tejidos profundos utilizando ultrasonidos focalizados marca un hito trascendental en la intersección de la ingeniería biomédica, la ciencia de materiales y la medicina. Este avance supera las limitaciones fundamentales de las técnicas anteriores de impresión in vivo, que estaban restringidas a aplicaciones superficiales, y abre un abanico de posibilidades sin precedentes para la intervención médica y la regeneración de tejidos.
La capacidad de fabricar estructuras biomédicas a demanda, con precisión tridimensional y en ubicaciones específicas dentro del cuerpo, tiene el potencial de revolucionar múltiples áreas de la medicina. Desde la reparación de tejidos lesionados (músculos, huesos, órganos) y la entrega controlada y localizada de fármacos (especialmente en oncología) hasta la creación de componentes para dispositivos médicos implantables o la ingeniería de interfaces biónicas, las aplicaciones son vastas y transformadoras. El uso de una biotinta inteligente, activada por el calor preciso de los ultrasonidos, ofrece un nivel de control y minimización invasiva que redefine lo que es posible en la fabricación aditiva dentro del organismo.
Si bien los resultados iniciales en modelos animales son extremadamente prometedores, y los primeros indicios sugieren que la biotinta podría ser no tóxica, el camino hacia la aplicación clínica en humanos aún requiere una investigación exhaustiva y la superación de varios desafíos. La optimización de las biotintas para diferentes aplicaciones, la mejora de la resolución y velocidad de impresión, la garantía de biocompatibilidad y seguridad a largo plazo, y la navegación de los complejos marcos regulatorios son pasos cruciales que deben abordarse.
No obstante, este experimento pionero de Caltech representa un cambio de paradigma. Ya no se trata solo de imprimir órganos o tejidos fuera del cuerpo con la esperanza de un trasplante exitoso; se trata de la posibilidad de intervenir directamente donde se necesita, utilizando el propio cuerpo como el entorno de fabricación, guiado por la precisión de los ultrasonidos. Este avance nos acerca un paso más a una medicina verdaderamente personalizada y regenerativa, donde las soluciones terapéuticas no solo se administran, sino que se "construyen" a medida dentro del paciente.
El futuro de la impresión 3D en biomedicina se vislumbra cada vez más dentro del propio organismo, y los ultrasonidos se perfilan como la herramienta clave para hacerlo realidad. Este hito, aunque aún en etapas tempranas, es un testimonio del ingenio humano y una promesa de las innovaciones que pueden surgir cuando la física, la ingeniería y la biología convergen para abordar algunos de los desafíos más apremiantes de la salud humana.
Para más información sobre los avances en bioimpresión y medicina regenerativa, puedes consultar publicaciones científicas especializadas (Placeholder para un enlace a una fuente relevante): Revista de Biofabricación y Medicina Regenerativa